2024年3月号
特集1
立体変形電極を用いたオンチップ培養脳モデル
- 生体計測
- 神経電極
- 組織工学
神経や脳の機能は、細胞どうしの電気的信号のやり取りにより成立しています。私たちは、生体に適合した導電性材料や微細加工技術を駆使することで、立体変形の可能な電極を並べたチップを作製し、神経細胞の集まった立体的な神経ネットワークからの電気的信号の計測を可能にしました。そして、そのチップ上で計測された電気的信号を時空間的に解析することにより、脳の神経細胞がどのような仕組みで働くのかを調べることができるオンチップ培養脳モデルを創出しました。
酒井 洸児(さかい こうじ)†1/後藤 東一郎(ごとう とういちろう)†1
手島 哲彦(てしま てつひこ)†2
NTT物性科学基礎研究所†1
NTT Research,Inc.
Medical and Health Informatics Lab†2
脳らしい構造のモデリング
生体組織の機能はその構造に大きく依存しています。血管や腸は管状であることで物質を流すことができ、骨格筋はファイバ状であるからこそ牽引力を生むことができます。脳も例外ではありません。脳は立体的であり、なおかつモジュール構造を特徴としています。例えば、モジュール構造についていえば、大脳は運動野、体性感覚野、視覚野など領野によって仕切られていて役割が異なります。それぞれの領野の中でも、神経細胞たちは一様には分布せず、細胞どうしが密に集まった塊と、それらの塊どうしが弱くつながった状態が維持されています。こうした大小問わず、ある役割を持った集団とそれが弱く結合した状態がモジュール構造と呼ばれており、モジュールどうしが同調的に働いたり個別に働いたりとバランスを取ることが脳の機能には必要とされています。
本研究では、こうした脳の構造がどのように同期現象に影響するのかを、培養神経細胞を電極基板上に育てるというアプローチで、ミクロなレベルから詳細に調べていきます。脳の組織からバラバラに分解した培養神経細胞でも、電気信号を発する特性は残っています。さらに、基板上に育つ細胞どうしで自然に神経ネットワークを形成するので、多点で配置した電極からは、細胞どうしのコミュニケーションの様子を見ることができます。一方で、平たい基板の上では、細胞は一様かつ平面に育つので、脳とは全く異なる構造の中に育っています。そのため、脳らしい立体構造やモジュール構造を再現するためには、培養神経細胞が育つための足場を組んだり、細胞を局所に集合させたりと人工的に構造を操る必要があります。私たちは、①電極を使って細胞の電気信号を計測すること、そして②所望の立体構造になるよう細胞を配置すること、の2つを両立するために、電極そのものを立体的な足場にするという方策を考案しました。
本稿では、まず電極の立体変形技術と、それを足場にして細胞を立体的に育てる技術を紹介します。その後、細胞の塊どうしをつないで立体構造・モジュール構造のいずれも再現したオンチップ培養脳モデルを作製します(図1)。脳モデルを使って実際に記録された神経信号について紹介した後に、最後に技術の発展性について概説します。
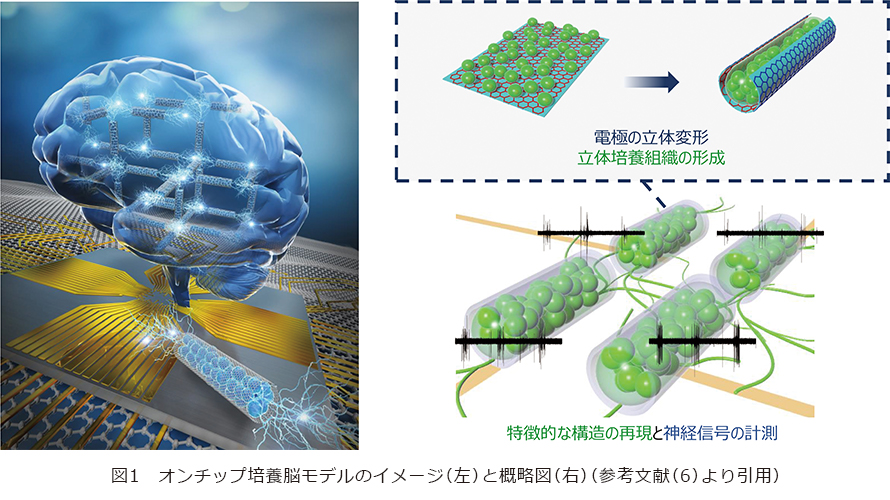
立体変形する電極と細胞を包む技術
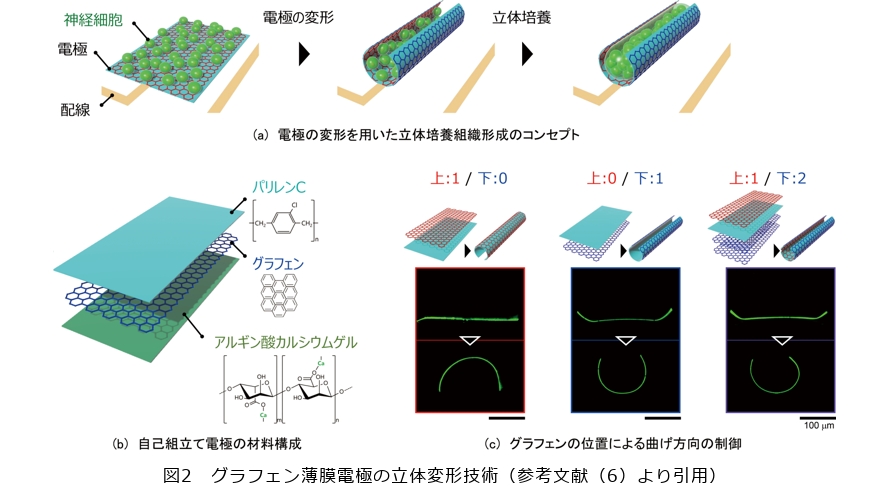
電極を細胞の足場にする具体的な方法として、私たちは、電極を立体的に曲げて、その中に細胞を包み込むという手法を創出しました(1)~(3)。図2の上段に概念図を示しています。立体的に培養細胞を育てる手法そのものは、組織工学*1やその発展であるOrgan-on-a-chip*2(臓器チップ)の技術分野で盛んに研究されているので、既存の立体的な足場に平たい電極基板(Microelectrode Array:MEA)を組み合わせるという方策ももちろん考えられます。しかし、平たい電極と立体培養組織との間で起きる接触状態の不良は信号強度の減弱を引き起こしてしまいます。Organ-on-a-chipにおいてセンシング技術が発展しにくい背景にも、センサチップの多くが平面的なために立体培養組織の表面に適合できないという難しさが根本にあります。そのため、電極も立体化して、形成された培養組織の表面に沿わせることが必要になるのです。電極は、細胞と同等のサイズ(10~100μmスケール)が求められますが、平面であればフォトリソグラフィ*3により作製が可能です。実際に、細胞を測るバイオセンシングの技術はフォトリソグラフィの加工精度により支えられています。一方で、このように精密につくられた電極を手動で折り曲げるのは困難です。
そこで、私たちは薄膜の自己組立てと呼ばれる手法に着目しました。2種類の材料から成る二層薄膜において、片方の層に収縮あるいは伸展の力が加わると薄膜は曲がります。自己組立てとは、基板上に二層薄膜を用意してあらかじめ片方に応力を加えておくことで、基板から薄膜が剝離する際に自発的な薄膜の屈曲を誘導する手法で、折り紙のように精密に薄膜を組み立てる方法として材料工学の分野で注目されています。典型的な変形の例は、長方形の薄膜から筒状への変形や、サイコロの展開図からキューブ状への変形が挙げられます。NTTでは、これまでにもシルクに代表される生体適合性材料*4による自己組立て技術を創出し、細胞を包むことに成功しています(4)。そのノウハウを活かし、さらに電極としても利用できる材料を探索しました。
私たちは、生体適合性、導電性、そして曲げが可能な柔軟性を兼ねそろえている点から、グラフェンと呼ばれる炭素原子一層から成る材料を選定しました(図2(b))。グラフェン*5は、脳に埋入する神経電極としても報告のある材料であり、神経計測と相性が良いことが知られています。グラフェンとともに自己組立てする薄膜の候補となる素材を何種類かスクリーニングした結果、パリレンCと呼ばれるポリマー素材が自己組立てを誘導できることを見出しました(2)(3)(5)。図2(c)に示す断面図を見ると分かるように、グラフェン・パリレンCから成る二層の薄膜は、基板上に張り付いている間は平らですが、ひとたび基板から剥がれると数秒ほどで曲がって筒状になります。ポイントは、グラフェンとの密着性の高さにあります。密着性が高いために曲がった際に剥離することがなく、基板上で生じた残留応力が曲げの駆動力として働いてくれます。パリレンCもまた神経電極の絶縁層に広く用いられる材料で、生体適合性と透明性にも優れているため細胞の観察にも適しています。
二層薄膜を基板に支持する役割を持つ犠牲層についても、材料選定にこだわりがあります。溶解時の培養細胞の生存に影響しないという観点から、犠牲層にはアルギン酸カルシウムゲル*6を選定しました。アルギン酸カルシウムゲルは、カルシウムイオン(Ca2+)を回収する試薬により培養細胞の生存に影響することなく溶解することができます。Ca2+を奪う試薬の添加から数秒の間に速やかに薄膜は基板から剥離し、自己組立てを完了します。アルギン酸カルシウムゲル、パリレンC、そしてグラフェンを含む三層の薄膜を積層した後に、フォトリソグラフィによって描画したマイクロパターンを保護層として、酸素プラズマを用いて三層を削ることで、フォトリソグラフィの精度で薄膜の形状を決めることができます。典型的には、100~1000μm辺の長方形をパターンとして描くと、パリレンCの膜厚に応じて変形後に半径10~200μmの筒状を得ることができます。この薄膜自己組立てを実現した際に一点だけ課題となったのは、必ずグラフェンを外側にして曲がるという特徴でした(図2(c))。培養細胞を包んだ際に絶縁性のパリレンC薄膜としか細胞が接触できません。そこで、私たちは、図2(c)の右に示すように、グラフェンによってパリレンC薄膜を挟んだサンドイッチ構造の薄膜を作製し、この薄膜でも自発的に曲げが誘導できることを見出しました。こうして、内側にグラフェンの導電層を有する自己組立て電極の創出に成功しました(6)。
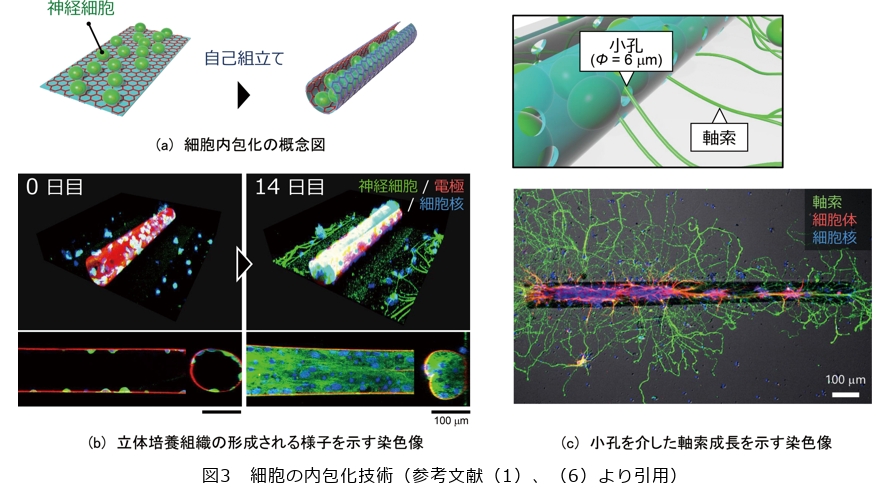
今回用いたグラフェンは生体適合性に加えて透明性にも優れているため、細胞を蛍光染色して顕微鏡下で観察することで、筒の中で細胞が育つ様子や立体培養組織が形成されるまでの過程を可視化できます(図3)。ラットの海馬から採取した培養神経細胞*7を含む液体を薄膜電極上に滴下して、神経細胞が沈んで電極表面に接するのを待った後に自己組立てを誘導すると、立体変形する電極に神経細胞が包まれます(図3(a))。図3(b)に示すように、最初は筒内部に点在している神経細胞ですが、時間が経つに連れて増殖や伸長することで組織の体積を大きくしていきます。培養1~2週間程度で筒内部をほぼすべて埋めるほどに組織の体積が増大し、筒の形状に沿った立体培養組織が形成されます。培養3~4週間以降も、ほとんどの神経細胞が生存しており、立体培養組織は筒内部に維持されます。実は、このように長い期間にわたって培養を維持するために、電極の構造に工夫を加えています。
細胞は培養液の供給が滞ると栄養や酸素が不足して生存できないので、立体的な組織を長期的に培養するうえでは組織の内部まで培養液を供給し続けることが求められます。筒を使った培養においては、外部からの培養液の供給が難しいため、細胞の生育には不利になります。そこで、図3(c)に示すように、筒の壁面に小孔を設けることで物質透過性を向上させるという対策を講じました(1)(2)。フォトリソグラフィの分解能を利用して3~6μmの小孔を設けることで、神経細胞を筒内部に閉じ込めたまま、物質の透過性を向上することができます。また、小孔の役割は、物質の透過性を向上させるだけではありません。筒内部に育てた神経細胞が筒外部と構造的に接続するための通路としても小孔は機能します。神経細胞は、軸索*8と呼ばれる細い突起を伸ばして他の神経細胞とつながり、神経ネットワークを形成します。本稿の冒頭で述べたようなモジュール構造を実現するためにも、立体培養組織どうしが軸索を通じてつながるように小孔を設けることが重要になります。図3(c)の下段は、実際に小孔を介して筒外部へと軸索(緑)が伸びる様子を染色像で示しています。細胞の本体〔細胞体(赤)〕は筒の内部にとどまったまま、軸索のみを筒外部へ伸ばし他の立体培養組織へ連結することが可能です。これにより、冒頭で述べた培養組織と電極のいずれも立体化するという技術的課題を解決し、次の課題であるモジュール化についても、軸索の通過するための小孔を設けることで立体培養組織どうしの連結を実現することができました。
*1 組織工学:再生医療に向けて、細胞を集めて目的の臓器の形や機能を持たせる技術分野です。
*2 Organ-on-a-chip:創薬の支援に向けて組織工学の発展した分野で、微小流体チップ上で細胞を培養し、薬物動態や安全性を試験する技術です。
*3 フォトリソグラフィ:感光性の液体を塗布し、露光、現像によりパターンを形成する技術で、半導体集積回路やプリント基板のほか、バイオセンサの作製にも広く用いられます。
*4 生体適合性材料:細胞や生体組織と親和性があり、生体の異物に対する反応を惹起しない性質を持つ材料です。
*5 グラフェン:炭素原子1層の厚みで構成される二次元材料で、高い導電性と透明性、生体適合性を有しています。
*6 アルギン酸カルシウムゲル:藻類に含まれる多糖類で、二価のイオンによって架橋されてゲルになります。二価のイオンを一価のイオン置換することで容易に溶解することができます。
*7 海馬由来培養神経細胞:海馬の神経細胞の多くは、興奮性神経細胞と呼ばれる結合先の神経細胞が発火するような入力を与える神経細胞です。
*8 軸索:細胞体から伸びる突起で、他の神経細胞へとシナプスを形成して結合します。
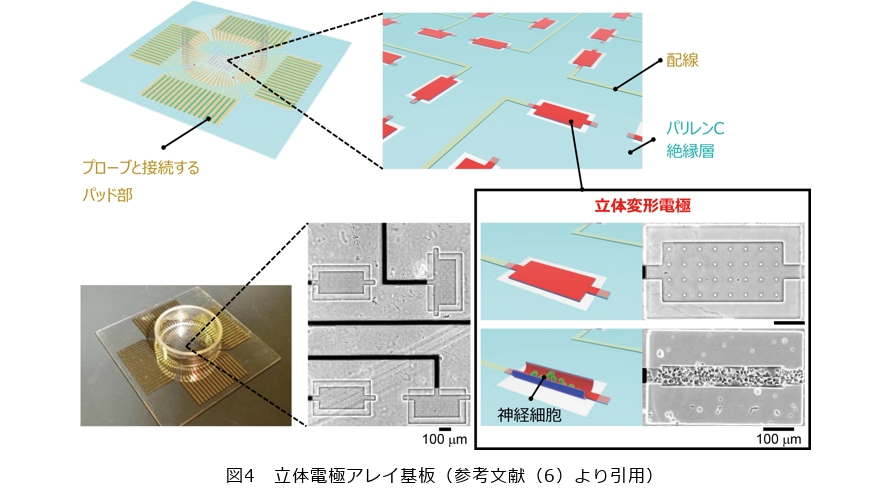
立体電極アレイを用いたオンチップ培養脳モデル
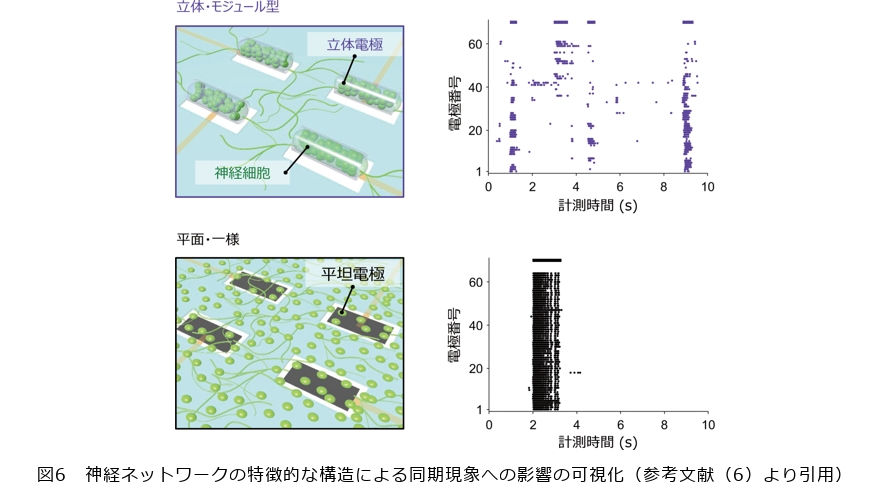
本稿の冒頭で述べたように、立体構造とは異なるもう1つの脳の特徴が、モジュール構造です。ここまで立体的な電極と培養組織の作製手法を紹介しましたが、私たちは、それらを複数つなげてモジュール構造を構築しました(6)。図4に示すように、立体変形能を持つ電極を8×8点のマルチアレイ状に並べた基板を作製し、それぞれの電極内部で立体培養組織を形成すれば、個々の立体培養組織をモジュールとした神経ネットワークがつくられます。神経細胞が自発的に軸索を伸ばすことで立体培養組織どうしは互いに結合します。立体培養組織に含まれる神経細胞どうしの密な結合と比べて弱い結合が立体培養組織間に形成されるため、結合の強弱の際立ったモジュール構造が構築されます。それぞれの電極を外部の計測機器に独立に配線すれば(図4)、個々の立体培養組織から発せられる神経信号が独立に計測されます。計測された神経信号の同期性や時間遅れなどを解析することで、複数の立体培養組織がどのような神経ネットワークを形成しているのかを調べることができます。このようにして、脳の構造的な特徴を再現しつつ、その神経ネットワーク内のやり取りを電気的に可視化する、オンチップ培養脳モデルが機能します。実際に作製したオンチップ培養脳モデルはどのように活用できるのか、私たちは、長期的な計測性能、そして特徴的な構造による同期現象への影響という2点に着目して、実験を行いました。
まず着目したのは長期的な計測性能です。平面的なセンサチップで課題となる、電極と立体培養組織との間の構造的なミスマッチが、立体的な電極であれば克服できるはずです。そのため、個々の立体培養組織からどの程度長く安定して計測が行えるかを確認しました。図5にその計測結果をまとめています。比較として、従来の平面的な電極上に立体培養組織を形成したところ、培養日数が進むにつれて計測信号が減弱し、最終的には消失する様子が見られました。原因は、構造的なミスマッチに加えて、培養細胞の移動する能力にあります。図5上段にも示すように、立体培養組織が平面電極から移動することで接触状態が悪くなり、計測信号は次第に減弱したと考えられます。一方で、立体変形した筒状の電極においては、筒の中に立体培養組織が固定されているので、組織と電極間の接触が良好なまま保たれます。図5下段に、培養日数に対する計測できた電極の数と記録された神経発火頻度の推移が示されていますが、立体電極では培養日数が経過しても計測信号は減弱せず、培養開始から70日後も計測が持続できることが実証されました。
続いて、神経ネットワークの構造と同期現象との関係を検証しました。神経細胞がつながった神経ネットワークの中では神経細胞は同期的に発火し、電気信号を発します。モジュール構造においては、神経細胞どうしが密に結合したモジュール内、つまり立体培養組織内の神経細胞どうしは同期的に発火しやすく、疎に結合したモジュール間での神経発火は比較的同期しにくい状態になっています。こうした構造的な特徴による同期性への影響を調べるために、モジュール構造と立体構造を持つネットワーク(立体・モジュール型ネットワーク)に加えて、比較対象として従来の平面的かつ一様に細胞が基板に生着した神経ネットワーク(平面・一様なネットワーク)からも自発活動の計測を行いました。図6は、それぞれの電極で発火が見られた時刻のプロットで、立体培養組織間における同期を可視化しています。平面・一様なネットワークでは、細胞どうしの結合が強く全体が同期した発火パターンが繰り返し支配的に現れます。一方で、立体・モジュール型のネットワークでは、いくつかの立体培養組織どうしが同期したパターンが多様に現れ、さらには同期現象に参加していない神経発火も混在するという結果が得られました。この結果は、立体培養組織どうしが同期的に働くパターンが多様である一方、一部のモジュール間では非同期的に発火するということを示しています。実際の脳内においても、こうしたモジュール構造により同期と非同期の混在した多様な発火パターンを生じることは情報処理に有利であることが理論的に示されています。本研究では、モジュール構造や立体構造の再現により実際に同期と非同期のバランスが変動することを実験的に証明しました。
長期的な計測性も併せて活かすことで、神経細胞の成長に応じた同期性の変化も追うことができます。例えば、軸索により立体培養組織どうしがつながり始める培養7~9日後では、完全に非同期的だった発火が次第に同期的になります。また、培養2~3週間を過ぎると、次第に全体的な同期発火が支配的になり、繰り返す同期発火の時間間隔も短くなります。こうした神経組織の成熟化に伴う電気生理的な変化を時系列で検証することで、脳の発達過程に関連した神経ネットワークの変遷についての理解も深めることができます。このように、本研究で構築したオンチップ培養脳モデルを使えば、筒のサイズや間隔といった形状のパラメータに加えて、培養日数を変えることで、神経ネットワークの構造や成熟に関連するさまざまな生命現象をその発火パターンから調べることができます。

技術の発展性
本稿では、脳らしい特徴として立体構造とモジュール構造を再現しつつ、電極チップ上に細胞を培養することで脳における神経ネットワークの機能をモデリングするという取り組みを紹介しました。単体としても他の細胞に比べて複雑で興味深い構造や特性を示す神経細胞ですが、それを培養する条件や基板の構造によっては集団としても振る舞いが変わるところに面白さや奥深さがあります。もちろん実際の脳とは根本的に環境が異なりますが、培養神経細胞に保存された特性を引き出すことで、脳の機能や発達に関連する新たな知見が明らかになる可能性があります。特に、細胞集団の構造や性質が脳に近くなるほど、今まで見えてこなかった細胞集団の振る舞いと脳の機能との関連性が徐々に明らかになっていくと期待しています。
また、本技術は、生理学的な範囲での現象だけでなく病理モデルとしての可能性も秘めています。例えば、神経ネットワークにおける構造の異常との関連性が知られる自閉症を模擬した神経ネットワークを構築することや、神経疾患の患者に由来するiPS細胞*9から作製した神経細胞を本モデルに混ぜることなどにより疾患・病態モデルを構築するような医学研究への展開も期待できます。実際の脳を使わずとも、脳らしい機能を持った神経ネットワークに対する薬剤応答を調べられるモデルになるので、実験動物の削減や薬剤の試験を加速するという観点でも、医学研究や創薬研究に対して貢献できると期待されます。
今後は、計測点数の増加や刺激機能の追加(光や熱、振動など)、電極立体形状の多様化によるチップの高性能化とともに、脳の機能や病理に関連した実際の事象をターゲットに定めることで、生命現象や疾患をより反映したオンチップ培養脳モデルの高度化をめざしたいと考えています。
*9 iPS細胞:人工多能性幹細胞(induced pluripotent stem cell)のことで、多くの細胞に分化できる分化万能性と、分裂増殖を維持できる自己複製能を併せ持っています。
■参考文献
(1) K. Sakai, T. F. Teshima, H. Nakashima, and Y. Ueno: “Graphene-based neuron encapsulation with controlled axonal outgrowth, ”Nanoscale, Vol. 11, No. 28, pp. 13249-13259, 2019.
(2) T. F. Teshima, K. Sakai, H. Nakashima, and Y. Ueno: “Self-foldable 3D graphene biointerfaces, ”NTT Technical Review, Vol. 18, No. 2, pp. 32-39, 2020.
(3) T. F. Teshima, C. S. Henderson, M. Takamura, Y. Ogawa, S. Wang, Y. Kashimura, S. Sasaki, T. Goto, H. Nakashima, and Y. Ueno: “Self-folded three-dimensional graphene with a tunable shape and conductivity, ”Nano Lett., Vol. 19, No. 1, pp. 461-470, 2019.
(4) T. F. Teshima, H. Nakashima, Y. Ueno, S. Sasaki, C. S. Henderson, and S. Tsukada“Cell Encapsulation and 3D Self-assembly Using Multi-layered Polymeric Thin Films, ”NTT Technical Review, Vol. 16, No. 8, pp. 53-61, 2018.
(5) T. Goto, T. F. Teshima, K. Sakai, and M. Yamaguchi: “Three-dimensional self-folding assembly of multi-layer graphene at the interface with a polymeric film, ”AIP Adv., Vol. 12, No. 7, 075002, 2022.
(6) K. Sakai, T. F. Teshima, T. Goto, H. Nakashima, and M. Yamaguchi: “Self‐Folding Graphene‐Based Interface for Brain‐Like Modular 3D Tissue, ”Adv. Funct. Mater., Vol. 33, 2301836, 2023.

(左から)酒井 洸児/後藤 東一郎/手島 哲彦







神経ネットワークを模倣した工学技術、AIがブームですが、まだ分かっていない神経ネットワークの役割を解明すれば、より高度な技術を生む一端になります。むしろ工学技術を駆使して生物の曖昧さを科学するという研究戦略の面白さを感じてもらえれば幸いです。