2024年3月号
特集1
人工細胞膜の構築のための脂質分子機能評価
- 脂質二分子膜
- 膜タンパク質
- 細胞
脂質や膜タンパク質は細胞間との情報伝達だけでなく、細胞内の小胞輸送など多くの反応にかかわっています。細胞の反応を分子レベルで理解するためのボトムアップアプローチとして人工細胞膜の研究に取り組んでいます。細胞膜の基本構造である脂質二分子膜に膜タンパク質を導入し、評価するためには、さまざまな要素技術が必要です。本稿では、細胞膜モデル基板の創出に向けた挑戦について紹介します。
大嶋 梓(おおしま あずさ)/樫村 吉晃(かしむら よしあき)
NTT物性科学基礎研究所
分子を組み上げてつくる脂質二分子膜再構成
細胞は脂質の膜で覆われ、細胞の内外を隔てています。この細胞膜には多様な膜タンパク質が存在しています。膜タンパク質は脂質膜に付着あるいは貫通して機能しているタンパク質で、細胞膜の重量のほぼ50%が膜タンパク質です。膜タンパク質には神経伝達物質などの信号分子を受け取る受容体タンパク質やエネルギーを使ってイオンなどを輸送するトランスポータなどがあります。そのうちイオンチャネル型受容体タンパク質はリガンド結合などにより受容体の構造変化が起こって、イオンチャネルが開くことによりイオンが細胞内へ流入し電位変化を誘起して情報伝達を行います。生体内での情報伝達は生命活動に不可欠で、情報伝達の異常はさまざまな疾病の原因になります。このように、膜タンパク質やその機能を維持する基盤となる脂質膜は、生体機能と密接な関係があり、それらの動きを理解することは生命科学においてだけでなく医療・創薬の面でも重要です。
では、どのように脂質やタンパク質を評価するのか、その手法の1つとして脂質二分子膜再構成系があります。再構成系は目的の脂質や膜タンパク質を任意の溶液や温度の下に組み上げ、特定の細胞膜上の現象を再現し、分子レベルでの評価を行います。脂質膜は脂質分子が二重に重なった厚さ5 nm程度の脂質二分子膜と呼ばれる構造です。脂質分子は水と馴染む親水性の頭部と水をはじく疎水性の炭化水素鎖を持つ分子であり、脂質分子そのものは水に溶けません。溶液中では脂質分子は自己集積化によって単分子膜が内側に疎水基を閉じ込めるように2枚重なった脂質二分子膜構造になります。
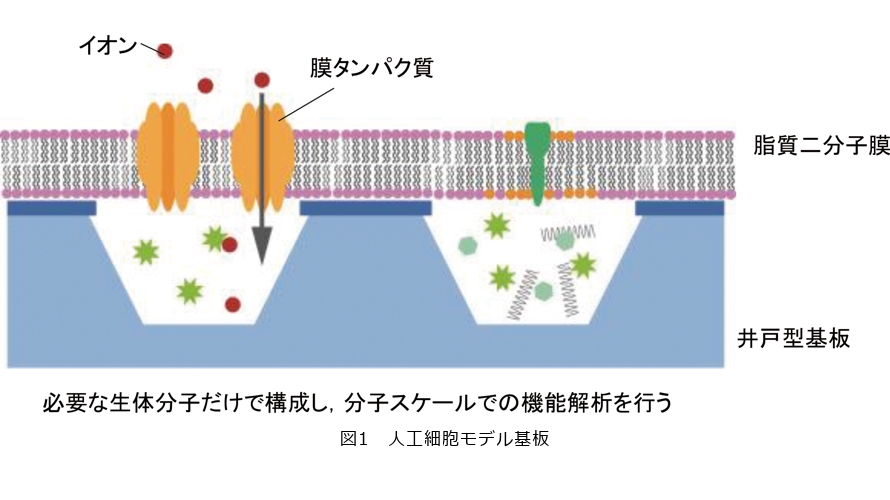
私たちは脂質二分子膜とナノ・マイクロスケール加工技術によって作製した井戸型基板を組み合わせた、脂質やタンパク質の機能評価を行う細胞を単純化したモデルの提案を行ってきました(図1)。このモデルでは脂質二分子膜で井戸を覆い、膜タンパク質を配置します。井戸内外が細胞内外を想定しており、井戸内外は任意の溶液で満たされています。井戸構造の1つは細胞1つと同程度の大きさに設計しています。この井戸構造は安定に脂質二分子膜を支え、平面型であるため、顕微鏡による経時変化観察が可能となります。井戸に形成した脂質二分子膜は井戸の淵の基板によって支えられていますが、脂質二分子膜と基板は物理的に吸着しておらず厚さ数nmの水層を介して存在しています。そして二分子膜を構成する脂質分子1つひとつは膜面内を動いていることが知られており、この脂質の動きは膜の状態を評価する指標となります。
本稿の前半ではこの細胞膜モデル基板を用いて脂質の相分離や脂質二分子膜形状の変化など脂質の特性機能評価について、後半は脂質二分子膜へ膜タンパク質をどのように導入するか、そして導入した膜タンパク質のイオン流入を評価するために必要な対策について紹介します。
脂質相分離膜
細胞膜を構成する脂質分子の種類は多様ですが、炭化水素鎖に不飽和結合を持たない飽和脂質と、1つ以上の不飽和結合を持つ不飽和脂質に大きく分けられます。これらの脂質分子は面内で一様に混ざり合っているのではなく、飽和脂質は細胞膜に存在するコレステロールと局所的にドメインを形成していると考えられています。この脂質のドメインはラフトとも呼ばれ、周囲の膜とは相状態が異なり、信号伝達に関与するタンパク質が局在します。役割や機能の解明が求められていますが、このラフトは細胞膜では直接観察することは難しいため、脂質分子の動きを物理的現象として理解するために再構成系が用いられてきました。飽和脂質・不飽和脂質・コレステロールの3成分の脂質二分子膜を作製すると、炭化水素鎖の秩序性を反映して不飽和脂質からなる無秩序液体相の中に飽和脂質とコレステロールが凝集した秩序液体相のドメイン構造が観察されます。秩序液体相は無秩序液体相より流動性が低く、分子密度が高いことが分かっています。
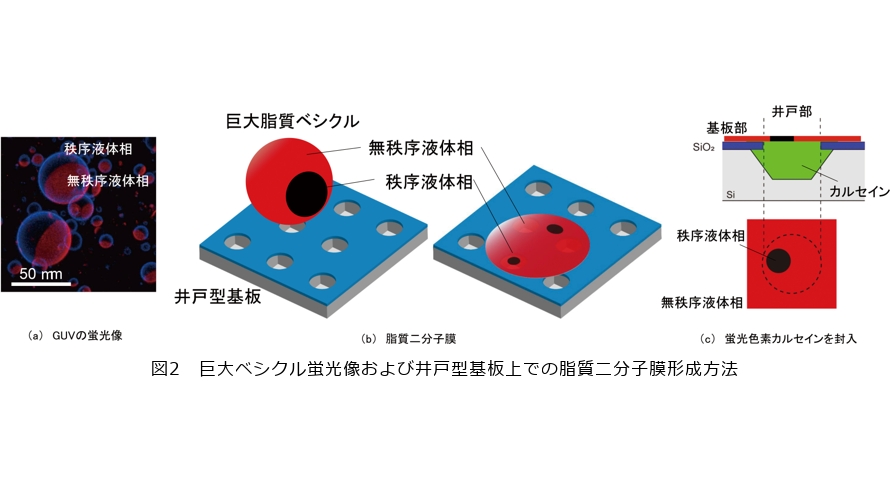
このような相分離膜を井戸構造上に展開すると、どのような振る舞いをするか観察をしました。井戸構造上に相分離膜を作製するために、まず巨大脂質ベシクル(GUV)を飽和脂質、不飽和脂質、コレステロールの3成分の脂質混合溶液から作製します。各相状態を見分けるために秩序液体相をLaurdan、無秩序液体相をRhodamine付脂質で蛍光標識しました。図2(a)は作製したGUVの蛍光像です。GUVは脂質二分子膜がシャボン玉と同じように球状の状態で、青い個所が秩序液体相、赤い個所が無秩序液体相を示しています。このGUVを図2(b)のように井戸基板上で展開させると井戸部をシールする脂質二分子膜ができます。脂質二分子膜が形成しているかどうかをより判別しやすくするために、井戸内部に蛍光色素カルセインを封入します(図2(c))。図3は相分離膜展開後に時間が経過した後の井戸基板の蛍光像です。赤い色が無秩序液体相、色がない暗い個所が秩序液体相を示しています。カルセイン由来の緑色の蛍光を見ることで脂質二分子膜が井戸部をシールすることに成功しているかどうかが確認できます(図3(a))。カルセイン由来の蛍光をフィルタすると(図3(b))シールに成功した井戸部はすべて赤色が観測され、無秩序液体相が優先的に存在しており、秩序液体相は井戸部外の基板部にのみ存在していることが分かりました(1)。
GUV展開直後には秩序液体相のドメインが井戸部でも確認されましたが、ドメインは井戸部内を動きながら時間経過とともに小さくなっていき、無秩序液体相の面積が増加し、最後には秩序液体相のドメインは井戸部内から消失しました。脂質二分子膜面内で脂質1つひとつが動いていますが、流動性の低い秩序液体相を形成する脂質(飽和脂質、コレステロール)は井戸部から基板部へ移動し流動性の高い無秩序液体相を形成する脂質(不飽和脂質)が井戸部へ入っていったと考えられます。井戸部内では脂質二分子膜は基板に接していないため、基板部のように基板-脂質の相互作用がなく動きやすい環境となっています。また支えがないので、形状がたわみやすいことが予想されます。
これらの結果から1枚の連続した脂質二分子膜でもそれを構成する脂質ごとに存在しやすい環境があることが分かってきました。秩序液体相・無秩序液体相がそれぞれ存在しやすい条件を解明し脂質の動きを制御することができると、より多様な細胞膜反応を再現でき、生体に近い細胞膜モデルが構築できると考えています。

脂質二分子膜の形状変化
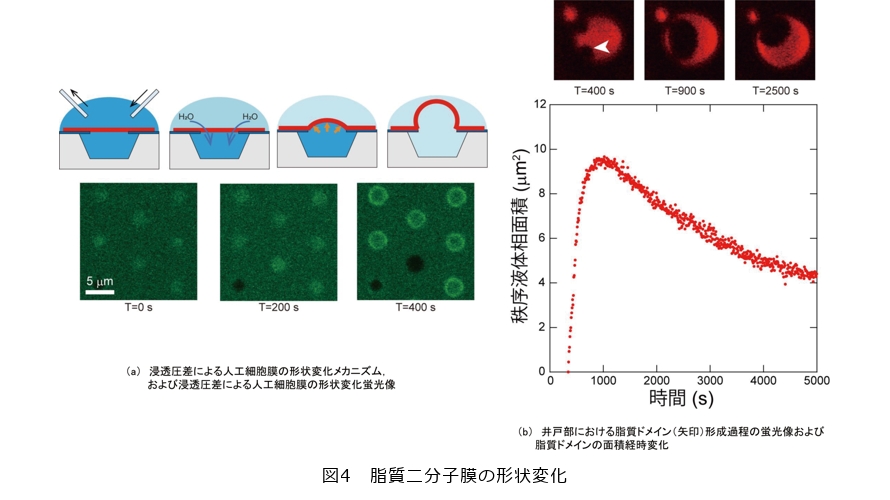
私たちの細胞膜モデルでは井戸部に無秩序液体相が優先的に存在しますが、秩序液体相を優先的に存在させることはできないのでしょうか。そこで、井戸部の脂質二分子膜の形状を変えたとき、相分離がどのように変化するかを観察しました。井戸内外は脂質二分子膜によって隔たれており、井戸外部は測定中に溶液を交換することが可能です。イオンや大型で電荷を持たない極性分子(アミノ酸やグルコース)は脂質二分子膜を透過しにくいですがH2OやO2など小さな分子は透過します。図4(a)の概略図に示すように井戸外の溶液を交換して井戸内外で浸透圧差を発生させると浸透圧差を解消するために脂質二分子膜を介して井戸内部へH2Oが流入して、井戸内部の溶液体積は増加していきます(2)。井戸部をシールする脂質二分子膜は流動性があるため井戸部から脂質が移動し、風船のように膨らんでいきます(図4(a)蛍光像)。飽和脂質、不飽和脂質、コレステロールの3成分の脂質二分子膜に対して浸透圧差を発生させると、浸透圧差のない等圧の状態では秩序液体相が減少していきましたが、脂質二分子膜が膨らんでいく過程で図4(b)の矢印で示す秩序液体相の面積が増加していきました。これは井戸部の周囲の基板部に存在する秩序液体相を形成する脂質(飽和脂質、コレステロール)が井戸内部の体積増加に伴って井戸部へ移動していったためです。井戸部の膨らみが終わり、井戸部のほとんどが秩序液体相に変化した後、1時間以上にわたって井戸部に秩序液体相を存在させることに成功しました(3)(図4(b))。脂質二分子膜の形状を変化させると脂質の動き方に変化が現れました。このように脂質二分子膜の動きを物理的に制御する手法は、脂質二分子膜の状態に影響を与える因子を検討していくために重要です。
昆虫細胞由来出芽ウイルスの膜融合機能を利用した膜タンパク質導入
脂質二分子膜へ膜タンパク質を効率的に導入することは再構成系において重要な課題となっています。膜タンパク質の機能を維持し、数や向きを制御して脂質二分子膜中に配置することができれば、多くの細胞膜反応が再現可能となります。バキュロウイルスは昆虫細胞を寄宿とするウイルスで、これに外来遺伝子を組み込み、昆虫細胞に感染させて目的のタンパク質を発現させる技術が確立されています。バキュロウイルスが昆虫細胞外に出芽する際、昆虫細胞の膜をまとうため、発現膜タンパク質が昆虫細胞由来出芽ウイルスに付加されています。昆虫細胞由来出芽ウイルスは次の寄宿へ侵入するために、細胞に融合する機能を持っています。
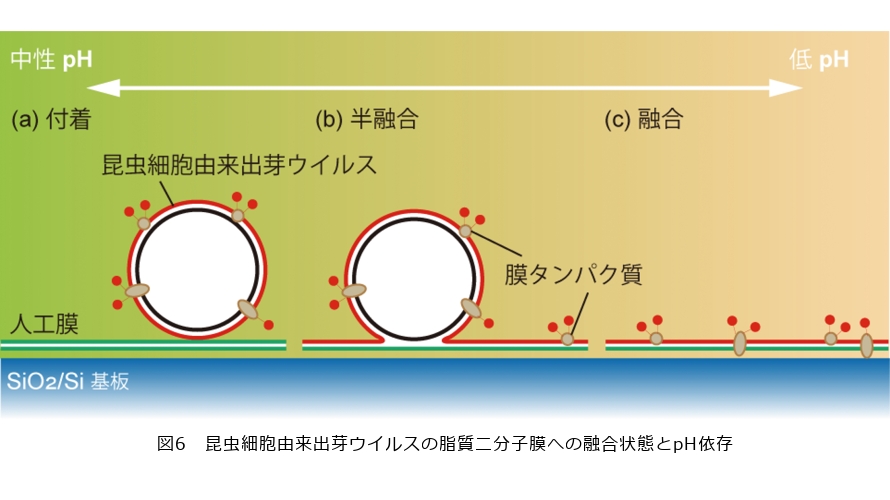
私たちはこの機能に着目し、脂質二分子膜への膜タンパク質導入を試みました(4)。昆虫細胞由来出芽ウイルス全体を蛍光標識し、シリコン基板上に形成した脂質二分子膜上に加え、pHの異なる溶液において脂質二分子膜上の昆虫細胞由来出芽ウイルス標識蛍光由来の蛍光強度の変化を調べました。1時間経過した後の蛍光強度変化が図5(a)です。グラフの横軸は溶液のpHを示しており、pHが5.5以下になると昆虫細胞由来出芽ウイルスを標識した色素由来の蛍光強度が上昇しています。これは昆虫細胞由来出芽ウイルスが脂質二分子膜へ到達した量の増加を示しています。pH6.0と5.5の間に昆虫細胞由来出芽ウイルスの融合能が活性化するしきい値がありそうです。
一方、pH5.5以下では蛍光強度だけ見ると大きな差はありません。脂質二分子膜どうしが融合するとき、膜どうしが付着した状態、いくらか混じり合った半融合、1枚の脂質二分子膜になる全融合と段階があり、付着の状態でそれ以上融合が進まない場合もあります。私たちの目的は膜タンパク質を脂質二分子膜へ導入することなので、昆虫細胞由来の膜成分が基板上の脂質二分子膜へ全融合した状態が望ましいのですが、それはどのpHで達成できているのか蛍光強度変化の結果だけでは分かりません。そこで脂質の側方拡散を測定することで、昆虫細胞由来出芽ウイルスの膜成分が脂質二分子膜へ移動しているか評価しました。Fluorescence recovery after photobleaching(FRAP:光褪色後蛍光回復法)法は任意の個所の蛍光色素を強い光で退色させ、側方拡散によって退色した蛍光色素と周囲の蛍光色素が入れ替わる過程から得られる蛍光回復曲線を解析し二分子膜面内の脂質や構成分子の動きの動きを評価する一般的な手法です。
図5(b)が蛍光色素を消光させた、色素が側方拡散によって動いていく過程の蛍光像です。この蛍光像の輝度の変化から各pHの蛍光回復曲線を得ました。pHが低くなるほど蛍光の回復率が上昇しています。これは昆虫細胞由来出芽ウイルスの膜成分が基板上の脂質二分子膜に移動し、拡散している割合が増えているため、pHが低くなるほどより全融合の量が増えていることを示しています。溶液のpHと膜融合状態の関係は図6に示すようにpH5.5付近では膜どうしが付着する割合が多く、pHが低くなるにつれて全融合の割合が増えることが分かりました。私たちの提案する細胞膜モデルにおいて、溶液pH4.5以下が膜タンパク質導入に最適な条件です。この溶液条件の下で井戸構造の脂質二分子膜へ膜タンパク質導入に成功しました。

膜タンパク質機能計測に向けて
次のステップは導入した膜タンパク質の機能評価ですが、そのためには解決すべき課題があります。私たちはこれまでにも細胞膜モデル基板によって、脂質二分子膜にポア形成しイオンを透過させる機能を持つ膜タンパク質α-ヘモリシンを通るイオンの流れを測定してきました。しかし外部溶液から井戸内部へのイオンリークが存在し、受容体膜タンパク質のようなピコアンペア(pA)レベルの極微小なイオン流入の信号を検出するためには、このイオンリークの低減を行う必要があります。理論および実験的な検証の結果、イオンリークの原因は、脂質二分子膜と井戸基板との間のわずか2nmほどの界面水層からのイオン流入であることが分かりました。低減方法として基板表面を牛血清アルブミン(BSA)で表面修飾することにより、イオンリークのパスとなっていた界面水層と外部溶液とのインタフェース部分をブロックする手法を提案しました(5)。
また最近、溶液としてイオン液体希薄水溶液を用いた簡便かつ容易な手法を見出しました。イオン液体はイオンのみからなる液体性の塩で、一般的に嵩高い有機イオンで構成されています。私たちは通常の無機塩の代わりにイオン液体を電解質として用い、嵩高いイオンを界面水層内に閉じ込めることによって界面水層を介したイオンリークを大幅に低減することに成功しました。これらの手法で形成した井戸基板上の脂質二分子膜を用いて長時間かつ高感度なα-ヘモリシンのイオン透過機能計測に成功しました。
今後の展開
脂質や膜タンパク質は細胞間との情報伝達だけでなく、細胞内の小胞輸送など多くの反応にかかわっています。脂質や膜タンパク質の動きを評価し、制御する手法を探索し細胞で起こっている反応を再現することで細胞では可視化が困難な各生体分子1つひとつの役割を定量的に評価する手法の提案をめざしています。NTTが得意とする生体材料に適応する基板加工技術によって脂質や膜タンパク質などの生体分子の動きを制御することで、生体内の複雑な伝達経路をボトムアッププロセスで紐解く脂質二分子膜再構成系の新たな展開が期待できます。
■参考文献
(1) K. Sumitomo and A. Oshima:“Liquid-Ordered/Liquid-Crystalline Phase Separation at a Lipid Bilayer Suspended over Microwells, ” Langmuir, Vol.33, No.46, pp.13277–13283, 2017.
(2) 大嶋・乾・上野・住友:“マイクロウエル架橋脂質二分子膜の水透過計測, ”電気学会論文誌 C, Vol.140, No.4, pp.421-425, 2020.
(3) A. Oshima, H. Nakashima, and K. Sumitomo:“Phase separation in freestanding bilayer lipid membrane induced by osmotic pressure difference, ”Jpn. J. Appl. Phys., Vol.59, No.2, 027001, 2020.
(4) A. Oshima, K. Nakanishi, N. Kasai, H. Nakashima, K. Tsumoto, and K. Sumitomo:“Mechanism of Budded Virus Envelope Fusion into a Planar Bilayer Lipid Membrane on a SiO2 Substrate, ” Langmuir, Vol.38 , No.18, pp.5464-5471, 2022.
(5) Y. Kashimura, K. Sumitomo, and H. Nakashima:“Biodevices using microwells sealed with artificial lipid bilayers:Improvement of sealing performance by protein coating, ” Electr. Commun. Jpn., Vol.103, No.9, pp.15-22, 2020.

(左から)樫村 吉晃/大嶋 梓







生体分子の動きを定量的に評価する新しい手法をめざして研究に取り組んでいます。