2023年1月号
特集
バイオデジタルツインの創出に向けた生体インタフェースの開発
- 生体インタフェース
- 生体電極
- 生体情報計測
バイオインフォマティックスとデータサイエンスの医療応用をめざすNTT Research, Inc. Medical and Informatics Lab(MEI Lab)は、サイバー空間上に患者さん1人ひとりのデジタルレプリカを構築するバイオデジタルツインTMの研究に取り組んでいます。2020年にはドイツにMEI Labミュンヘンオフィスを設立し、材料科学をベースとした生体電極インタフェースの開発を開始しました。本稿では、特にミュンヘン工科大学(TUM)と共同で行っている研究の内容の進展について解説します。
手島 哲彦(てしま てつひこ)†1、3/Joe Alexander †2/Bernhard Wolfrum †3
NTT Research, Inc. Medical and Informatics Lab†1
NTT Research, Inc. Medical and Informatics Lab所長†2
ミュンヘン工科大学 ミュンヘン生物医学工学研究所†3
MEI Labミュンヘンオフィスのミッションと研究体制の構築状況
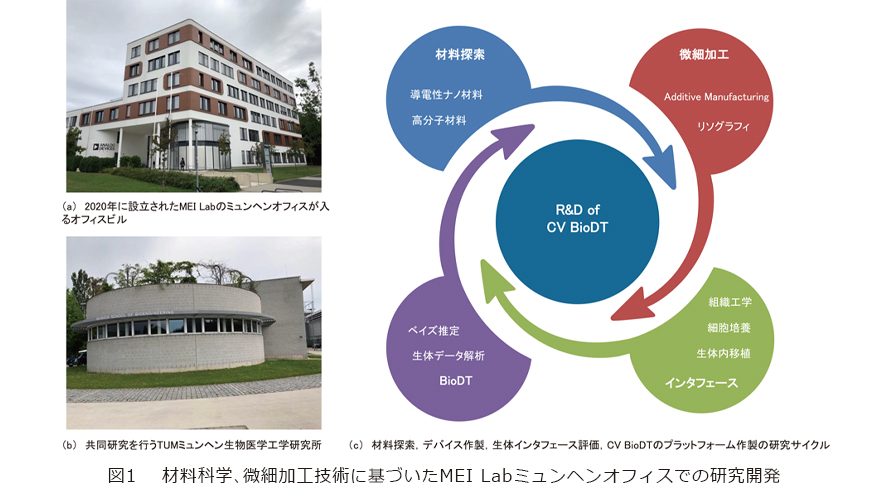
NTT Research, Inc. Medical and Informatics Lab(MEI Lab)は、バイオインフォマティクスとデータサイエンスを融合し、人体のデジタルレプリカを作成するバイオデジタルツイン(Bio Digital Twin:BioDT)技術の構築をめざしています。特に、心血管系や神経系のBioDTをターゲットとし、医師が患者1人ひとりに合わせた最適な治療方法をシミュレーションできるプラットフォームの開発に取り組んでいます(1)。このプロジェクトの中でMEI Labミュンヘンオフィスは、実験科学に立脚した生体インタフェースの研究開発を目的として、2020年3月に設立されました(図1(a))。特に、生体に埋め込むための電極やセンサを作製し、心血管系や神経組織を介して生体組織や臓器の機能を制御し、さらに生体情報を正確に読み取ることでBioDT技術を支援できるような治療・診断システムの開発に取り組んでいます。
生体の中に電極やセンサを埋め込んだ際、それらのデバイスは生体組織を傷つけずに、長期間安定的に電気計測や電気刺激を行うことが必要となります。従来型の神経および筋肉組織との電気刺激用インタフェースは、主にステンレス鋼や白金イリジウムなどの無機材料が用いられてきました。一般的にこれらの金属は、多孔性の表面加工を施すことでインピーダンスを下げ、電荷注入効率を上昇させる必要がありました。その結果、電極表面からの金属の溶出や金属の有する高いヤング率から生体組織への有毒性や損傷を与えることが懸念されています。そのため、硬い無機材料ではなく、生体組織と同様の柔軟な機械的特性を持ち、さらに毒性がなく体内の湿潤環境下でも電気化学的に安定な材料を用いて生体電極を作製する試みが、近年世界中でなされています。
そのための材料を選定するために、私たちはミュンヘン工科大学(TUM)との共同研究を開始し、柔軟材料を用いてさまざまな「柔らかい電極・センサ」を試作してきました(図1(b))。特に私たちがこれまで培ってきた導電性ナノ材料やソフトマテリアル、微細加工技術、さらにナノ材料自身の自己組織的な三次元組立て現象に関する知見をベースとして、複雑な形状を有する生体組織にしっかり密着するような三次元状の電極を開発しました(図1(c))。さらにTUMの得意とする電気化学測定技術やモデルとなる実験動物の神経系を用いて、作製された電極の有効性の評価を行いました。本稿では、試作した生体電極と実験動物を用いた研究内容について、その一例を紹介します。
柔らかい神経インタフェースの作製
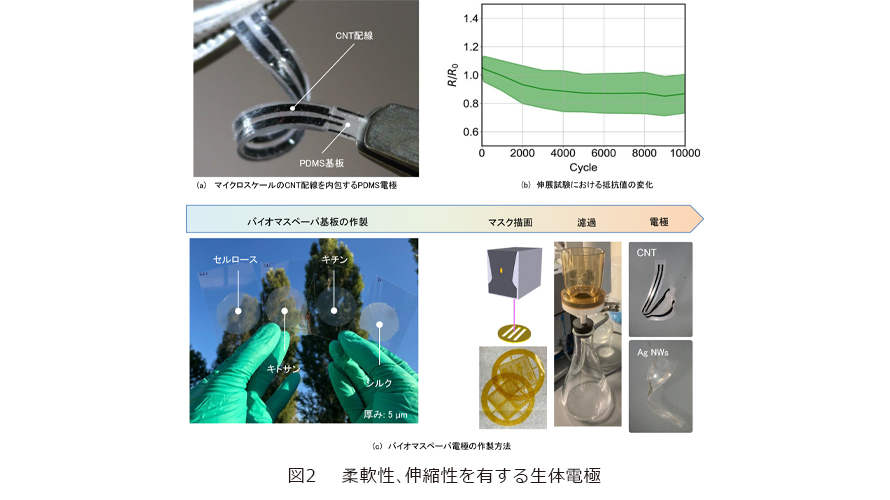
柔軟性を有し、伸長しても破断しない生体電極のための材料として、基材部分にシリコン材料を、電極層にカーボンナノチューブ(CNT)を採用しました(2)。高アスペクト比で比表面積が大きいナノ材料であるCNTは、組織液と触れると静電容量が高くなってより多くの電荷を蓄えることができます。また金属よりも大きな電位窓を有するため、水の電気分解を生じない条件下でより高い電位に分極し、電気分解から発生するファラデー電流による生体組織への損傷を避けることができます。この材料を、伸縮性のあるポリジメチルシロキサン(PDMS)に埋め込み電極パターンを形成しました(図2(a))。私たちはCNTの持つ高アスペクト比に着目し、市販の低価格なワックスインクジェット印刷機と濾過フィルタのみを用いるだけで、ミクロンスケールの微細な電極配線を形成するという工夫も試みています。この手法では、濾過フィルタに所望のパターンを直接ワックスプリントで描画し、それを通じてCNT懸濁液を真空濾過することで、100 μm程度のCNTから成る細線を作製することができます。これを未硬化のPDMSに転写することで、CNTが表面に埋め込まれた伸縮可能な電極を簡便につくることができ、1万回以上にも及ぶ一軸伸張サイクル耐久試験や400万回以上にも及ぶ電気パルスの連続印加を行っても、電気配線の抵抗値や電極インピーダンスに著しい低下が見受けられませんでした(図2(b))。これにより歪みが加わっても電気接続が切断されず、さらには信号対雑音比が向上してより低い電流閾値で標的組織を刺激誘導できる生体電極を作製することに成功しました。
PDMSのようなシリコン樹脂は人工的に合成された高分子材料ですが、合成高分子だけでなく、バイオマス由来の生体により優しい天然高分子材料から構成された生体埋め込み用電極の開発にも同時に取り組んでいます。例えば多糖類であるキトサンは、甲殻類や節足動物の外骨格や真菌類の細胞壁から単離される直鎖型グルコサミンのキチンを脱アセチル化して得られ、その高い生物分解性と火傷治癒機能から近年食品添加物から神経組織や皮膚の再生材料などとして幅広く利用されています。それを基材とした電極の作製を試みました。キトサンはそれ自体が水溶性ですが、弱酸にしか溶解せず、成形加工が難しいという問題がありました。そこで私たちは、株式会社スギノマシンと共同でキトサン粒子をナノファイバ化し、それらを「漉く」ことで天然高分子から成る薄くて透明なバイオマス紙を基材として用いることにしました(3)。さらにその表面にレーザ加工を施したフィルタを設置し、CNTの懸濁液を「濾す」ことにより、溶剤を一切用いずに所望の形状を有する電極を紙の表面にパターニングすることが可能となりました(図2(c))。
この手法はさまざまな材料に応用が可能であり、本来の紙を構成するセルロースや繭から単離されるシルクなどのナノファイバを用いて基材となるバイオマス紙をつくることができます。さらに電極部分としてCNTだけでなく金属製のナノワイヤやある程度の分子量を有する導電性高分子などの導電性材料を用いて、電極配線をつくることができます(図2(c))。これらの透明な紙でできた電極は折り曲げても、10%以上の引張歪みを加えても破断せず、さらには曲げや歪みに対して抵抗値がほぼ一定値を示すなど、安定した導電性を有します。またシリコンなどの合成高分子に比べて、天然由来の高分子には生体内での溶解性や損傷した生体組織の治癒効果など、さまざまな機能を付加することが可能です。そのため電気刺激や計測を行いながら、同時に生体組織の治療や薬剤投与が可能な電極の多機能化が期待されています。
昆虫を用いた神経インタフェースのモデル
作製された生体電極がいかに生体内で動作するかを検証するには、それに適した実験動物のモデルが必要となります。特にBioDTへの応用をかんがみた場合、例えば迷走神経の電気刺激が慢性心不全や心筋梗塞に有効であり、心筋梗塞の急性期に安定して迷走神経を刺激できる電極の開発が求められています。このように迷走神経などの神経線維を効率良く刺激ができる電極の材料や形状の最適化のための実験動物のモデルが必要ですが、元来ドイツ当局は動物実験、とりわけ哺乳類動物に関して厳しい倫理規程と制約を設けており、齧歯類などの実験動物を大学などの研究機関で安易に使用することを禁じています。そこで私たちは、痛覚のなく倫理的に問題がない、かつ誰でも簡単に扱える比較的大きな神経線維を有する生物として、環形動物であるヒルや節足動物のバッタに着目しました。
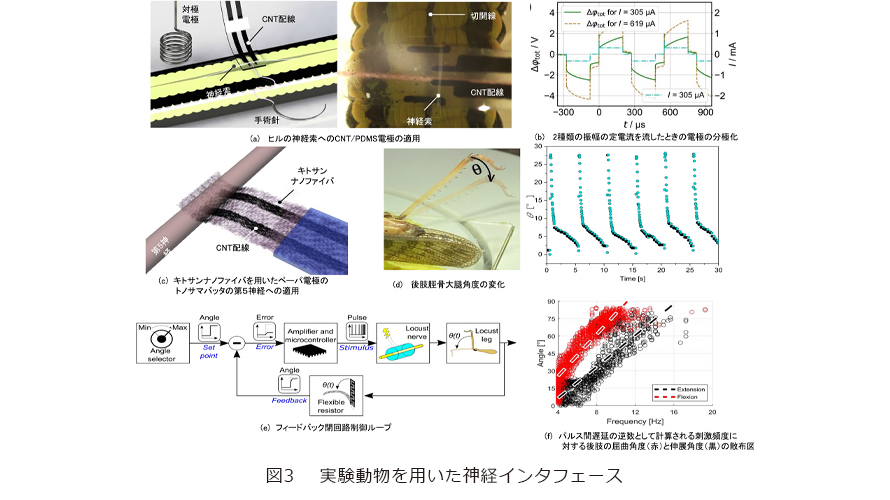
私たちが用いたヒルは、馬蛭(Haemopis sanguisug)と呼ばれる種類で、一般的に池や沼地に広く生息し、日本では平安時代から夏の季語としても親しまれている動物でもあります。このヒルを氷水に20分間ほど浸すことによる麻酔をかけた後、腹側を上に向けて、ヒルの両端と中央を固定し、腹側正中線に沿って小さく切開すると、神経索を露出させることができます。この体節神経節ニューロンは、感覚情報処理や行動選択の意思決定を司っています(2)。そこで前述したCNT/PDMS電極を神経索と神経鞘の間に留置し、白金対極電極との間に一連の電荷平衡二相電流パルスを印加してみると、体全体に収縮運動がみられました(図3(a))。刺激しきい値は、振幅、周波数、パルス数、2つの刺激トレイン間の最小時間によって規定されます。特筆すべきことに、パルス列中の総電荷量を増やしていっても収縮強度に差が生じない一方、周波数が0.5Hz以下になると、収縮の強度が目に見えて低下しました。これは、収縮が標的神経領域で誘発された活動電位によるものであり、数ミリ秒程度の軸索活動電位の不応期よりもはるかに長い刺激時間に設定すると、刺激の繰り返しに追従できずに収縮筋の弛緩の動きが緩慢になることが原因であると考えられます。この際の電極の分極は振幅を増やしても電位差は最大1.5Vほどに達しますが、電極が十分に大きな表面積を持っているため、全体的な分極への寄与は非常に小さく、CNTの電極が水の電位窓内にとどまりながら活動電位を正確に引き出すことに成功しました(図3(b))。
バッタも体節神経節を中心とするはしご形神経系を有する動物です。私たちが用いたトノサマバッタ(Locusta migratoria)は、後肢の脛骨大腿角度が、容易に定量できるバイオマーカです。その後肢には後胸部神経節の第5神経が伸筋運動神経として接続しているため、この第5神経内の高速脛骨伸筋ニューロンの刺激を通じて電極の機能を検証しました(図3(c))。前述したキトサンナノファイバでできた透明紙電極を神経下部に挿入し、5秒ごとに電荷平衡二相電流パルスを印加すると脛骨において、急激な屈筋収縮による伸展とそれに続くゆっくりとした屈曲が観察されました(3)。また、印加する電流パルスの振幅やパルス数によって伸展角度を調節でき、200μAの電流で伸展角が最大となることも分かりました(図3(d))。
このシステムにフィードバック閉ループ制御機構を組み込むことで、伸筋運動神経に対する刺激の周波数を調節し、バッタの脚の平均角度をリアルタイムで制御することが可能となります(図3(e))。誘発された脚の平均角度を柔軟な抵抗器で定量化し、マイコンで実装された比例制御アルゴリズムを介して、フィードバックします。すると、外部コンピュータを必要としない単一入出力のフィードバックループ制御によって、周波数に応じて後肢の伸展・屈曲を制御できました(4)。周波数に対応した伸展・屈曲の角度分散は線形クラスターにより識別され、刺激前の状態に依存する屈筋神経のフィードバック信号によりお互いに差異が生じることが観察されました(図3(f))。今後は本回路を用いて、さらにバイオマーカと選択的刺激ユニットの数を増やすことで、より複雑な動きの制御を行う研究に取り組んでいく予定です。
変形能を有する柔らかい電極開発
ヒルやバッタの神経系を用いた実験から、埋め込まれた生体電極が神経に接触する位置によってインピーダンスが劇的に変化し、電極と神経線維がいかに密着するかが、刺激や信号計測効率を上げるための方法であることが分かりました。このため、カフ型の電極のような、電極と神経線維の界面をより強固にする工夫が必要となります。その知見を材料研究にフィードバックすることで、現在私たちは「自己変形能」という新しい材料の機能を発現するプロジェクトを始動しています。その1つの方法として、生体内に多く含まれる組織液に着目しました。生体電極を体内に入れた瞬間に組織液を吸収して膨潤することで、その体積変化が駆動力となり電極構造を変化させます(図4(a))。
その一例として、一般的に紙おむつや保冷剤の材料として用いられる高膨潤性ポリアクリル酸と膨潤しにくいポリウレタンという異なる2つの材料を張り合わせた二層構造に電極配線を行うと、膨潤によりカフ構造に可逆的に変形し、神経にやさしく巻きつく電極を開発しました(5)。これにより、伸展・屈曲の角度が3倍以上増加するなど、より低いインピーダンスによる刺激・記録効率の飛躍的な向上を達成できました(図4(b))。このポリアクリル酸以外にも、コンタクトレンズの材料として用いられるシリコンハイドロゲル複合材料や、ナノファイバペーパと紙増強材であるハイドロゲルの複合材料などを用いて、現在神経線維径に巻きつくカフ電極の作製に世界で初めて成功しています(図4(c)、(d))。私たちは材料化学的な側面からアプローチし、自己組織的に形状が変形して神経線維や心臓の表面に密着してくれるような「知能」を有する電極材料を探索することで、複雑な手技を必要としないBioDTを支援する電極の開発にも取り組んでいます。

まとめと今後の展望
この2年半にわたり、MEI Labミュンヘンオフィスは、研究体制構築の面で大きな進展をみせています。TUMでは世界中から集まった優秀な大学院生とともに小さなグループをつくり、生体電極の作製や動物実験を進めながら、微細加工用の装置や材料試験機などを購入して研究設備を整えてきました。そこで構築した研究のサイクルとして、最終目標であるBioDTに向けた4段階のステップがあります(図4)。はじめに、導電性や伸縮性、自己変形能などの機能を有する材料探索や電気化学的評価を行います。次に、三次元(3D)プリンタやリソグラフィ技術、レーザ加工などの手法を組み合わせることで、探索した材料をデバイス化します。その後、信号計測や刺激用のセットアップを組み立てることで、心筋・神経の細胞や組織とのインタフェースの評価を行った後、BioDTのアルゴリズムの構築をめざします。
これらのサイクルはIOWN(Innovative Optical and Wireless Network)構想(1)の重点キーテクノロジとして、先端材料、アディティブマニュファクチュアリング、ヒューマンマシンインタフェース、バイオメディカルにそれぞれ該当し、本サイクルを繰り返していくことでNTT Research, Inc.オリジナルのBioDT技術の開発に努めていきたいと考えています。今後は、電極のプロトタイプを用いて昆虫だけでなく哺乳類動物の生体組織への応用や、再生医療技術とBioDTを組み合わせたOrgan on Chip型BioDTの創出など、ミクロスケールが生体レベルまでさまざまのスケールでのBioDTモデルとの融合をめざし、個別化された治療「Precision Medicine」の実現を支援する技術開発を進めていく予定です。
■参考文献
(1) 澤田・井伊・川添:“IOWN構想—インターネットの先へ,”NTT出版,2019.
(2) K. Terkan, F. Zurita, T. J. Khalaf, P. Rinklin, T. Teshima, T. Koh, and B. Wolfrum:“Soft peripheral nerve interface made from carbon nanotubes embedded in silicone,”APL Materials, Vol. 8, No. 10,article id.101111,2020.
(3) D. Ando, T. F. Teshima, F. Zurita, H. Peng, K. Ogura, K. Kondo, L. WeiB, A. H. Iwata, M. Becherer, J. Alexander, and B. Wolfrum: “Filtration-processed biomass nanofiber electrodes for flexible bioelectronics,” Journal of Nanobiotechnology, Vol. 20, No. 491,2022.
(4) F. Zurita, F. D. Duca, T. Teshima, L. Hiendlmeier, M. Gebhardt, H. Luksch, and B. Wolfrum:“In vivo closed-loop control of a locust’s leg using nerve stimulation,”Scientific Reports, Vol. 12, No. 10864, 2022.
(5) L. Hiendlmeier, T. Teshima, F. Zurita, H.Url, P. Rinklin, B. Wolfrum:“A Superabsorbent Sodium Polyacrylate Printing Resin as Actuator Material in 4D Printing,”Macromolecular Materials and Engineering, Vol. 307, No. 2200306, 2022.

(左から)Joe Alexander/Bernhard Wolfrum/手島 哲彦







MEI Labでは、TUMと共同でBioDT技術に向けたバイオインタフェースの研究開発に取り組んでいます。TUMでは、欧州だけでなく南米やアジア、アフリカなど世界中から集まった優秀な大学院生と共同で実験を進め、チーム一丸となって研究開発に取り組んでいきます。