2024年3月号
特集1
超伝導磁束量子ビットによる神経細胞中の鉄イオン検出
- 超伝導量子回路
- 量子センシング
- バイオマテリアル
超伝導量子計算機の開発競争を背景に、近年発展の著しい超伝導量子回路技術が量子センシング分野に応用されています。これまで、超伝導量子センサによるオンチップ測定のターゲットは半導体中の不純物等に限られていましたが、応用範囲はそのような「固い」材料に限りません。本稿では、超伝導磁束量子ビットを応用した高感度・高空間分解能磁場センサによる神経細胞中の鉄イオンの検出について紹介します。
樋田 啓(といだ ひらく)†1/酒井 洸児(さかい こうじ)†1
手島 哲彦(てしま てつひこ)†2/角柳 孝輔(かくやなぎ こうすけ)†1
Imran Mahboob†1/齊藤 志郎(さいとう しろう)†1
NTT物性科学基礎研究所†1
NTT Research,Inc.
Medical and Health Informatics Lab†2
生体中の微量金属元素
鉄は生体内に含まれる量は少ないものの重要な役割を果たす微量金属元素の1つです。生理学側面ではヘモグロビンによる酸素の輸送やATP(Adenosine triphosphate)*1によるエネルギー産生に関与し、病理学的側面ではアルツハイマー病など多くの神経変性疾患に関係します。これらの現象の理解には、鉄イオンの輸送や酸化数の変化等を詳細に調べる必要があります。
*1 ATP:アデノシン三リン酸。細胞はATPを経由してエネルギーを利用しています。
生体試料中の金属イオンを調べる方法
生体試料中の金属イオンを調べるための代表的な手法として、質量分析法が挙げられます。この手法は定量性を持つ手法で、細胞単位での分析も可能です。しかし、分析の過程で誘導結合プラズマやレーザ照射によるイオン化、すなわち細胞の破砕を伴うため、その場観察は難しくなります。また、ラマン分光法などの光学的手法も金属元素の分析に使われます。ラマン分光法は光を用いた方法であることからその場観察に適しており、細胞内部の構造のイメージングも可能です。しかし、ここまで挙げた方法では原理的に酸化還元反応やタンパク質との結合等に起因するイオンの価数の変化をとらえられないので、これらの情報を得るためには異なる手法が必要です。
イオンの価数等も含む生体試料中の金属イオンの分析に用いられるのが電子スピン共鳴(Electron Spin Resonance:ESR)で、物理・化学・生物・地球惑星科学・製薬・医療等のさまざまな分野で幅広く応用されています。この手法では、g因子と呼ばれる「材料の指紋」ともいえるパラメータを求めることで、イオンの価数も含む金属イオンの違いを見分けることが可能です。通常の場合、分析は細いガラス管に試料を充填して行うため、数ミリリットル単位の試料を用意することが必要で、得られる情報もその平均値となります。また、空間分解能と感度の制約から、細胞単位でのイメージングは難しくなります。
超伝導量子回路*2による磁場センサはマイクロメートルレベルの空間分解能を持ち、ESRと同様に金属イオンをはじめとする不対電子*3を持つ物質の分析が可能です。そのため、生体内の金属イオンを細胞単位で調べるための有用なツールとして期待できます。
*2 超伝導量子回路:量子力学的にふるまう回路素子を含む超伝導回路。超伝導量子回路は通常の電子回路と同じインダクタ、キャパシタのほかに、非線形な電流・電圧特性を持つジョセフソン接合で構成されます。
*3 不対電子:原子や分子に含まれる電子のうち、ペアを構成していない電子を指します。不対電子を含む物質は磁性を持つため、磁化の源になります。また、不対電子を含む物質の性質はESRによって測定することができます。
超伝導量子回路を用いた量子センシング
超伝導量子回路を用いた量子センシングでは、主に磁場もしくはその源である電子スピンの超高感度測定をめざしています。物質中で電子スピンは環境となる周辺元素の性質を反映するプローブとして働き、材料分析のツールとして用いることができます。
超伝導量子回路を用いたセンシングの研究は大きく2つの方向で進められています。1つは、既存のESRで感度を制約する原因となっている増幅器の雑音等の要素を超伝導量子回路の技術で徹底的に改善し、超高感度をめざすものです。もう1つは、磁場に対して敏感な特性を持つ種類の超伝導量子ビットをセンサとして用い、電子スピンを高い感度で検出するものです。どちらの方法も、超伝導量子回路チップ近傍の試料に含まれる電子スピンを超高感度で検出するという点では共通しています。NTTは後者のアプローチで研究を行っており、長年研究を続けてきた超伝導磁束量子ビットを磁場センサとして用いています。これまでに1秒間の信号の積算で20個の電子スピンを検出可能な超高感度センサを実現し、それを応用することでESRにより固体試料をマイクロメートルの空間分解能で分析することに成功しました(1)(2)。
超伝導量子回路を用いたセンシングデバイスのもう1つの特徴は、センサとして働く超伝導量子デバイスの大きさを小さくすることができ、高い空間分解能を実現できる点です。例えば、超伝導磁束量子ビットは1辺の長さが数マイクロメートル程度の長方形状のループから構成されます。超伝導磁束量子ビットはループを貫く磁場のみを選択的に検出するため、マイクロメートルスケールの空間分解能での測定が可能です。
超伝導磁束量子ビットによる電子スピンセンシングの高感度・高空間分解能という特徴は、生体試料測定への応用で特に威力を発揮します。数マイクロメートルという超伝導磁束量子ビットのサイズは典型的な細胞のサイズとちょうど同じ程度ですので、1つひとつの細胞を見分けられる空間分解能が得られることになります。また、超伝導量子ビットは量子計算機応用をめざした集積化も進んでいるので、この技術を応用し超伝導磁束量子ビットの2次元的なアレイを作製すれば、単一細胞レベルの空間分解能での元素イメージングを行うことも可能です。
本研究では、細胞単位でのイメージングへ向けた第一歩として、超伝導磁束量子ビットを用いて細胞中の微量金属元素を測定する原理検証実験を行いました。その結果、神経細胞中の鉄イオンを単一細胞レベルの空間分解能で測定することに成功しました(3)。
超伝導磁束量子ビットによる電子スピンの測定方法
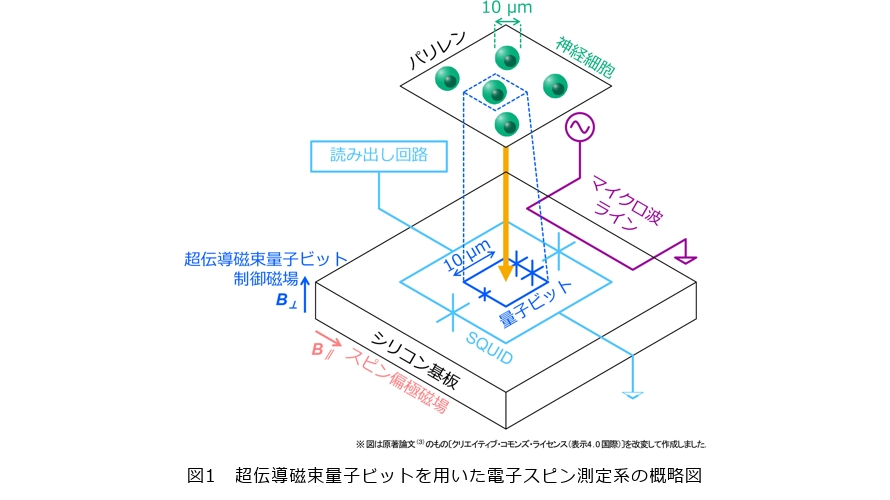
超伝導磁束量子ビットを用いた電子スピン測定系の概略を図1に示します。超伝導磁束量子ビットと測定対象の神経細胞を希釈冷凍機の中に設置し、実験は200mK以下(−272.95℃以下)の温度で行いました。生体試料をこのような極低温まで冷却して測定することはほとんどありません。生体と低温という組合せから、神経細胞の様子が低温では変わってしまい、有益な情報が得られないのではという懸念があるかもしれません。しかし、本研究の測定のターゲットは試料中の金属イオンですので、低温でも測定は可能です。また、電子スピンの測定では、一般的な特性として温度を下げるほど感度が高くなるので、量の少ない金属イオンを測定するには、低温環境のほうが望ましいといえます。
超伝導磁束量子ビットは、シリコン基板上に作製しました。図1のとおり、超伝導磁束量子ビットはジョセフソン接合*4(図中では×記号で表しています)を3つ含むループ状の素子で、ループを流れる左回り・右回りの電流を2つの量子状態に対応させることで、量子2準位系を構成します。さらに、超伝導磁束量子ビットは超伝導量子干渉素子(Superconducting Quantum Interference Device:SQUID)*5に囲まれています。このSQUIDは常温に設置した増幅器・アナログ-デジタル変換器・PC等に接続されていて、超伝導磁束量子ビットの量子状態を読み出します。超伝導磁束量子ビットの2準位間の遷移周波数は、ループを貫く磁束を変えることにより変化します。この磁束は、超伝導磁束量子ビット近傍に取り付けた超伝導磁石から磁場(図1の超伝導磁束量子ビット制御磁場)を与えることにより制御します。
超伝導磁束量子ビットによる電子スピン測定の原理を図2に示します。先述のとおり、通常、超伝導磁束量子ビットは外部の超伝導磁石により制御しますが、超伝導磁束量子ビットの近傍にスピンを持つ試料があり、それが磁場の源となる場合も同じように超伝導磁束量子ビットの共鳴周波数を変化させます。試料に含まれる磁性体が常磁性*6を示すものであれば、試料の磁化、すなわち試料に含まれる電子のスピンのそろい具合は温度と試料に印加する磁場で変えることができます。低温・強磁場の場合、熱揺らぎにより電子スピンがばらばらな向きを向く効果より、磁場の向きに沿って電子スピンがそろう効果が大きく、結果として試料は大きな磁化を示します(図2の青枠)。一方、高温・低磁場の場合、熱揺らぎにより電子スピンはばらばらな向きを向くため、試料は小さな磁化を示します(図2の赤枠)。試料の磁化が変化することにより超伝導磁束量子ビットのループを貫く磁束が変化するので、超伝導磁束量子ビットの共鳴周波数が変化します。したがって、磁場(図1のスピン偏極磁場)や温度を変えながらある動作点での超伝導磁束量子ビットの共鳴周波数の変化、もしくはそれに対応するスペクトルの磁場軸方向のシフト量を測定することにより、試料の磁気的性質を明らかにすることができます。ここで、スピンのそろい具合を制御する磁場は図1の超伝導磁束量子ビット制御磁場とは異なることに注意が必要です。
実際に測定を行う場合、対象となる試料と超伝導磁束量子ビットの距離を小さくするほど両者の磁気的相互作用が大きくなるため、電子スピン検出の感度が高くなります。しかし、測定対象である生体試料は、場合によっては液体を含む場合もあり、絶縁性が期待できません。そのため、超伝導磁束量子ビットを正常に動作させるためには、両者の間に絶縁膜をはさむことが必要です。両者を十分絶縁しつつ、高い感度を実現するために距離を近づけるには工夫が必要です。そこで、生体適合性が高く、厚さが数マイクロメートルと非常に薄い高分子膜(パリレン)を絶縁に用いることでこの課題を解決しました。
生体試料としては、ラットの海馬から採取した神経細胞を用いました。神経細胞はパリレン膜の上に直接培養しています。また、細胞に鉄などが多く含まれる神経変性疾患をはじめとする病変を模擬するため、培養は鉄イオンを添加した培地で行いました。図3に示したとおり、このような培養法を用いることにより通常の培地で培養したものに比べて鉄イオンを多く取り込んだ神経細胞を調製しました。
神経細胞を培養したパリレン膜は、超伝導磁束量子ビットを作製したシリコン基板の上に置き、測定を行います。超伝導磁束量子ビットのループサイズは24×6μm2の大きさで、神経細胞のサイズと同程度です。したがって、実験で得られたデータは単一の細胞の性質を反映したものと考えることができます。
*4 ジョセフソン接合:超伝導体の間にごく薄い絶縁膜を挟んだ構造の素子で、超伝導量子回路においては非線形素子として使われます。
*5 超伝導量子干渉素子:2つのジョセフソン接合を持つループ状の素子で、高感度磁束計として利用されます。
*6 常磁性:外部から磁場を与えない場合に電子スピンの向きはばらばらで、磁場の印加により電子スピンの向きがそろい、磁化を示す磁性のこと。


超伝導磁束量子ビットによる神経細胞の測定
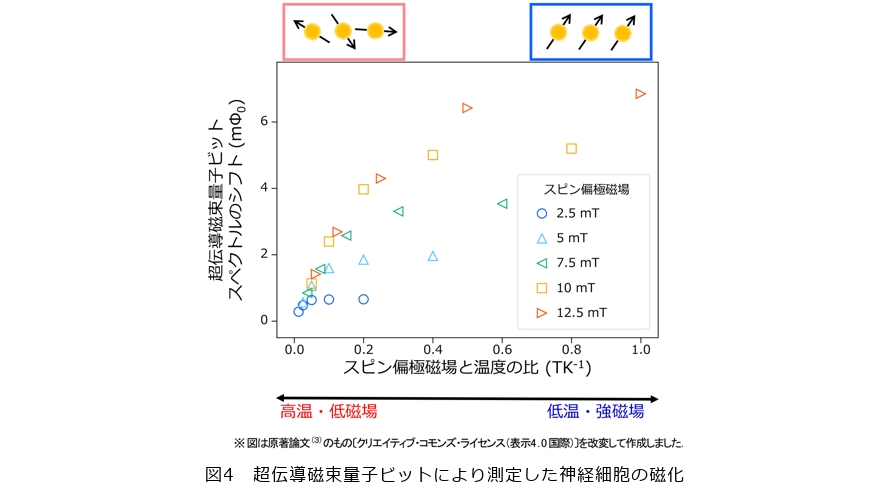
はじめに、神経細胞の磁化を検出する実験を行いました。実験は、パリレン上に神経細胞を培養した試料に、いくつかの異なる磁場[数mT(ミリテスラ)程度]を印加した状態で試料の温度を変えながら、超伝導磁束量子ビットの共鳴周波数の変化に対応するスペクトルのシフトを測定することで行いました。図4から温度を下げる、または大きな磁場を印加するにしたがって超伝導磁束量子ビットのスペクトルが大きくシフトする、すなわち試料が大きな磁化を示すことが分かります。この結果は、試料に常磁性体が含まれている場合に期待されるふるまいと矛盾しないものです。したがって、神経細胞とパリレンのどちらか、もしくは両方に何らかの常磁性を示す物質が含まれていると考えられます。
次に、神経細胞とパリレンのどちらが磁性を示すかを検証するために、同じ実験条件でパリレンのみの測定を行いました(図5)。パリレンは炭素と水素から成る不対電子を含まない高分子膜であり、基本的には磁性を示さないものと期待されますが、電子線照射などのダメージによりわずかに磁性を示す場合があることが知られているため、このような対照実験が必要です。その結果、パリレンの磁化は神経細胞よりも有意に小さいことが分かりました。したがって、図4でパリレン上に培養した神経細胞から検出した磁化は、ほとんど神経細胞に由来するといえます。
ここまでの結果で、神経細胞に何らかの常磁性体が含まれていることは分かります。しかし、それがどの元素に由来するものなのかは分かりません。そこで、低温でのESRを得意とする静岡大学の小野・堀研究室と連携し、さらに試料を分析しました。ESRスペクトルからは、g因子を得ることができます。この値をすでに知られている材料固有のg因子と比較することで、磁性の起源となる元素の同定が可能になります。
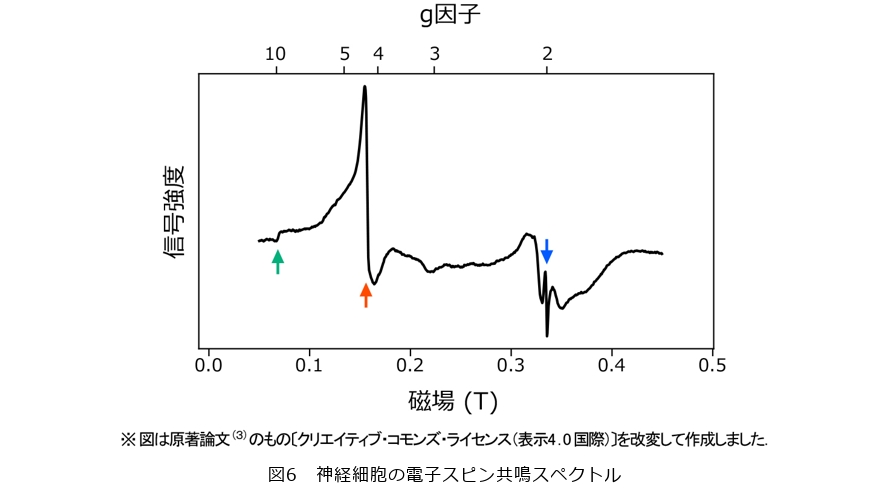
神経細胞の電子スピン共鳴スペクトルを図6に示します。このスペクトルにはg因子9.8、4.3、2.0に対応するピークがみられます。g因子9.8、4.3は、細胞中の3価の鉄イオンに対応することが知られており(4)、ピークの大きさからこれが試料の磁化の主な起源だといえます。この結果と、これまでに超伝導磁束量子ビットによる測定で得られた結果を合わせることで、神経細胞中の鉄イオンを単一細胞レベルの空間分解能で検出したといえます。また、g因子2.0のピークは2価の銅イオンによるものと考えられ、量は少ないものの鉄以外の元素も磁化に寄与していたことが分かります。
ここまで、超伝導磁束量子ビットを用いて、神経細胞中に含まれる金属イオンについて定性的な分析を行ってきました。さらに、超伝導磁束量子ビットを用いた磁化測定の結果からは、神経細胞中に含まれる金属イオンの定量も可能です。超伝導磁束量子ビットの共鳴周波数の変化量は磁化の大きさに対応します。したがって、別に行った電子スピンの濃度が既知の参照試料の実験結果と比較することで、共鳴周波数の変化を金属イオンの数に換算することができます。その結果、測定したラット海馬の神経細胞には乾燥状態で1g当り8μgの鉄が含まれるという結果を得ました。これは、ヒトの脳細胞で行われた先行研究(4)(5)で得られた2~34μg/gという値と、対象は異なるものの矛盾しない結果です。

今後の展望
超伝導磁束量子ビットを用いた量子センシング技術を応用することで、神経細胞中の金属イオンを単一細胞レベルの空間分解能で検出し、定性的・定量的に分析することに成功しました。
今後の課題としては、神経細胞のESRスペクトル測定を、超伝導磁束量子ビットを用いて単一細胞レベルの分解能で行うこと、また、超伝導磁束量子ビットをアレイ化することにより組織中の細胞に含まれる金属イオンの2次元イメージングを行うことなどが挙げられます。
■参考文献
(1) R. P. Budoyo, K. Kakuyanagi, H. Toida, Y. Matsuzaki, and S. Saito:“Electron spin resonance with up to 20 spin sensitivity measured using a superconducting flux qubit,”Appl. Phys. Lett., Vol. 116, No.19, 194001, May 2020.
(2) 齊藤・水野・竹中・樋田・角柳:“超伝導量子回路に基づく量子情報技術,”NTT技術ジャーナル, Vol.35, No.4, pp.18-22, 2023.
(3) H. Toida, K. Sakai, T. F. Teshima, M. Hori, K. Kakuyanagi, I. Mahboob, Y. Ono, and S. Saito:“Magnetometry of neurons using a superconducting qubit,”Commun. Phys., Vol. 6, No. 19, Feb. 2023.
(4) P. Kumar, M. Bulk, A. Webb, L. van der Weerd, T. H. Oosterkamp, M. Huber, and L. Bossoni:“A novel approach to quantify different iron forms in ex-vivo human brain tissue,”Sci. Rep., Vol. 6, 38916, Dec. 2016.
(5) L. H. P. Vroegindeweij, L. Bossoni, A. J. W. Boon, J. H. P. Wilson, M. Bulk, J. Labra-Muñoz, M. Huber, A. Webb, L. van der Weerd,and J. G. Langendonk:“Quantification of different iron forms in the aceruloplasminemia brain to explore iron-related neurodegeneration,”NeuroImage:Clinical, Vol. 30, 102657, April 2021.

(上段左から)樋田 啓/酒井 洸児/手島 哲彦
(下段左から)角柳 孝輔/Imran Mahboob/齊藤 志郎







超伝導量子回路の応用として量子計算機が特に注目を集めていますが、量子センシングも応用が期待される分野の1つです。超伝導とバイオという意外な組合せに面白さを感じてもらえれば幸いです。